Theo AP, cuộc kiểm tra từ cuối tháng 2 đến đầu tháng 3 vừa được FDA công bố sơ bộ khẳng định Global Pharma Healthcare đã thiếu các biện pháp đảm bảo vô trùng tại nhà máy của họ ở Ấn Độ.
Các thanh tra y tế từ FDA tiết lộ nhà máy này - tọa lạc tại bang Tamil Nadu ở miền nam Ấn Độ - sử dụng "quy trình sản xuất thiếu sót" trong thời gian từ tháng 12-2020 đến tháng 4-2022 đối với các sản phẩm đã được chuyển tới Mỹ.
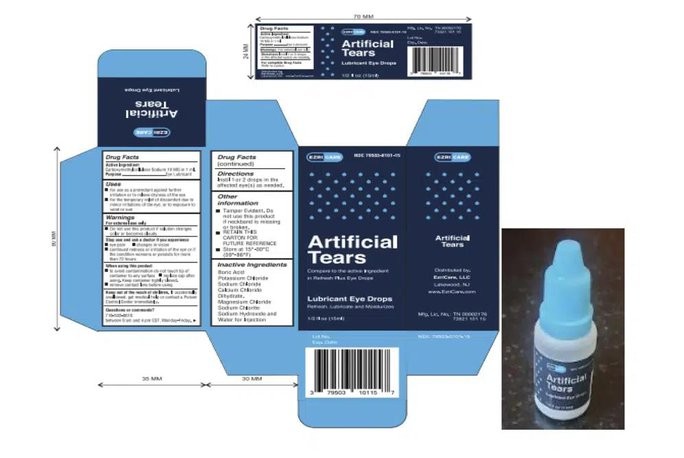
Sản phẩm thuốc nhỏ mắt này được xác định là có liên quan đến 68 ca nhiễm khuẩn ở Mỹ, trong đó có 3 người đã tử vong và 8 người bị mất thị lực. Bốn người đã phải phẫu thuật múc bỏ nhãn cầu do nhiễm trùng nặng.
Hai nhà phân phối Mỹ là EzriCare và Delsam Pharma đã thu hồi thuốc nhỏ mắt này vào tháng 2.
Đợt bùng phát nhiễm khuẩn mắt này được coi là đặc biệt đáng lo ngại bởi có khả năng gây ra tình trạng kháng kháng sinh tiêu chuẩn.
Các thanh tra y tế đã đến nhà máy vào ngày 20-2, hơn 2 tuần sau khi thuốc bị thu hồi. Họ đã mô tả nhà máy này có tường và trần nhà không dễ lau chùi, không một thiết bị nào trên máy chiết rót được bọc hoặc che phủ, không có quy trình nghiêm ngặt để đảm bảo các lọ thuốc được niêm phong hoàn toàn, chỉ có kiểm tra bằng trực quan thủ công...
Theo Anh Thư - nld.com.vn


